In dieser Einheit werden wir uns mit Metallen beschäftigen, ihren Eigenschaften, der Gewinnung und der Bearbeitung. Dabei werden wir Redoxreaktionen als chemische Reaktionsform kennenlernen und immer intensiver mit dem PSE und dem chemischen Rechnen beschäftigen.
Da ihr auch dieses Mal keine Chemiebücher dabei habt, werde ich hier wichtige Texte und hilfreiche Videos für die Arbeitsaufträge zusammenstellen. Bitte fasst die wichtigsten Aussagen in euren Heftern zusammen und bearbeitet dann die Aufgaben.
Zum Beginn jeder Doppelstunde (nach Stundenplan) werden wir uns kurz zu den Ergebnissen der Aufgaben austauschen (ca. 15 Minuten), bevor ihr das nächste Kapitel bearbeitet. Dazu werde ich bei Sdui eine eigene Chatgruppe einrichten. Während der Doppelstunden werde ich versuchen, eine Videokonferenz einrichten. Nachdem wir uns kurz zu den Aufgaben ausgetauscht haben, könnt ihr euch bei Bedarf einwählen, um eventuell Fragen zu klären oder Aufgaben zu besprechen.
Wenn wieder ein Präsenzunterricht möglich ist, werde ich eure Hefter einsammeln und eure Arbeit bewerten.
Kapitel 1 – Metalle und ihre Eigenschaften
Ca. 70% aller Elemente des Periodensystems und damit aller Elemente auf der Erde sind Metalle und damit unsere wichtigsten Werkstoffe.
Ein kleines Einstiegsvideo zu Metallen: Chemie | Metalle : Welche Metalle gibt es? (br.de)
Eigenschaften der Metalle
Mit ihren typischen Eigenschaften sind Metalle aus unserem Leben nicht mehr wegzudenken. Sie dir zu den wichtigsten Eigenschaften das folgende Video an. Chemie: Metalle : Metalle und ihre Eigenschaften (br.de)
Recherchiere im Internet nach weiteren spezifischen Eigenschaften. Bearbeite mit Hilfe deiner Aufzeichnungen und dem Internet die folgenden Aufgaben. Ein gutes Hilfsmittel könnte die folgende Webseite sein, die einige von euch auch schon als App auf ihr Handy geladen haben:
Merck | Periodic Table of Elements (merckgroup.com)
Aufgaben
- Nenne wichtige Eigenschaften der Metalle.
- Stelle in einer Tabelle die Schmelztemperatur und die Siedetemperatut von Magnesium, Aluminium, Zinn, Kupfer, Silber, Gold und Quecksilber zusammen.
- Nenne Beispiele für die Verwendung von Kuper.
- Wie kann man Aluminium und Blei unterschieden?
Kapitel 2 – Reduktion – Redoxreaktion
Wie ihr bereits gelernt habt, ist ein typisches Beispiel für eine Oxidation eine chemische Reaktion, bei der ein Stoff mit Sauerstoff zu einem Oxid reagiert. Meist wird bei dieser Reaktion Wärme frei (exotherm).
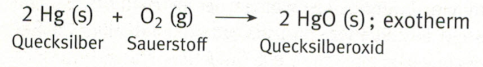
Eine chemische Reaktion, bei der einem Oxid der Sauerstoff entzogen wird, nennt man Reduktion.

Möchte man aus Kupferoxid den Sauerstoff entfernen (reduzieren) gelingt dies nicht mit einem einfachen Erhitzen. Hier nutzt man die Eigenschaften von Kohlenstoff. Bei der folgenden Reaktion oxidiert Kohlenstoff mit dem Sauerstoff aus dem Kupferoxid zu Kohelnstoffdioxid (Oxidation) wodurch der Sauerstoff aus dem Kupferoxid reduziert wurde.
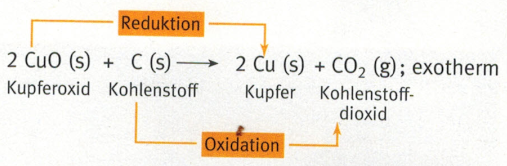
Hinweis: die kleinen Buchstaben in den Klammer geben den Aggregatzustand an.
- (s) – solid – fest
- (g) – gaseous – gasförmig
- (l) – liquid – flüssig
im Teilchenmodell
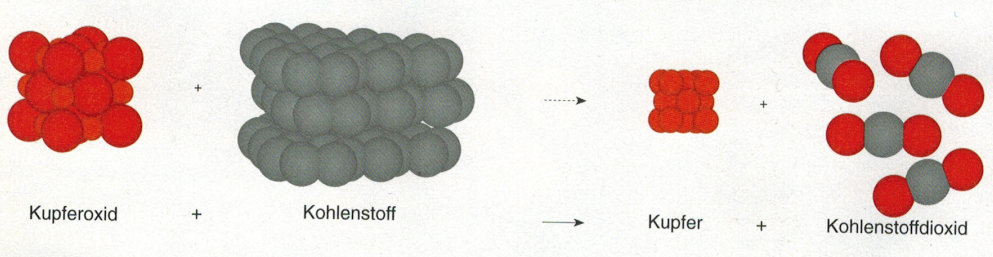
Reaktionen, bei denen eine Oxidation und eine Reduktion gleichzeitig ablaufen, nennen man Redoxreaktionen.
Redoxreihe der Metalle
Um dieses Thema genauer zu betrachten, nehmen wir als Beispiel eine Redoxreaktion, in der Kuperoxid mit Eisen zu Kupfer und Eisenoxid reagieren.
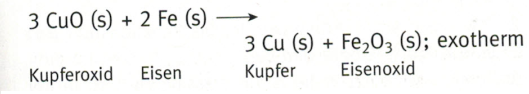
Prüft nun einmal selbst, ob ihr bereits erkennt, wo hier die Oxidation und wo die Reduktion stattfindet und welches Element das Oxidationsmittel und welches das Reduktionsmittel ist. Lies erst dann weiter…
Eisen reduziert Kupferoxid und ist daher das Reduktionsmittel. Kupferoxid ist als das Oxidationsmittel.
Eisen reduziert also Kupferoxid. Umgekehrt kann Kupfer jedoch Eisenoxid nicht reduzieren. Man sagt, Eisen ist ein stärkeres Reduktionsmittel als Kupfer. Um nun Eisenoxid zu reduzieren könnte man Aluminium als Reduktionsmittel nutzen, da Aluminium ein stärkeres Reduktionsmittel ist als Eisen. Dadurch entsteht eine Reihenfolge der Reduktionswirkung unter den Metallen, die in der Chemie als Redoxreihe der Metalle bezeichnet wird.?
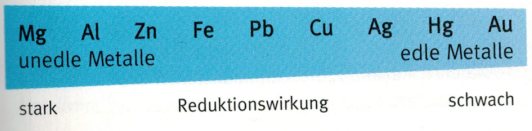
In der Redoxreihe stehen link starke Reduktionsmittel. Diese Metalle oxidieren bereits in der Luft sehr schnell. Wir nennen diese Metall unedle Metalle. Auf der rechten Siete finden wir z.B. Gold, dass, wie ihr sicher wisst, zu den Edelmetallen zählt und an der Luft nicht oxidiert.
Um Redoxreaktionen algemeiner zu betrachten, müssen wir uns mit ganz besonderen Teilchen in der Atomhülle beschäftigen, die im Atommodell von Dalton keine Rolle spielen. Sie sind aber ein wichtiger Grund dafür, dass Atome sich, wie im Teilchenmodell oben, verbinden, sortieren oder trennen.
Aufgaben: (Lade deine Ergebnisse diesmal bitte in Sdui bis nächste Woche hoch.)
- Nenne weitere unedle Metalle und Edelmetalle.
- Zink reagiert mit Silberoxid (Ag2O). Stelle die Reaktionsgleichung auf und ordne die Begriffe Oxidation, Reduktion, Oxidationsmittel und Reduktionsmittel zu.
Kapitel 3 – Redoxreaktion als Elektronenübergang
Allgemein ist eine Redoxreaktion eine chemische Reaktionen bei der Elektronen von einem Reaktionspartner auf einen anderen übertragen werden. Sie bestehen aus zwei Teilreaktionen. Bei der Reduktion nimmt ein Stoff Elektronen auf und bei der Oxidation gibt er Elektronen ab.
Um diese Zusammenhänge zu verstehen, werden wir nun ein neues Atommodell kennenlernen, was euch bis in die höheren Klassenstufen begleiten wird.
Das Bohrsche Atommodell
Das Bohrsche Atommodell basiert auf den Erkenntnissen, die Rutherford und andere Wissenschaftler zuvor gesammelt haben. Dazu seht ihr euch bitte zuerst das Video in der Cloud des Aufgabenchats „9b Aufgaben 20/21“ in Sdui an. Anschließend das Video zu Niels Bohr (ebenfalls in der Cloud). Notiert euch dazu die wichtigsten Punkte zum Schalenmodell in eurem Chemie-Hefter.
Zeichen des Schalenmodell für Wasserstoff, Stickstoff, Eisen und Kupfer. Gib jeweils die Anzahl der Elektronen auf der äußersten Schale an. Diese werden als Valenzelektronen bezeichnet.
Als Zusammenfassung des Themas habe ich noch ein Video in Sdui (9b Aufgaben) und im Chemie-Chat zur Verfügung gestellt.
Kapitel 4 – Technische Anwendung von Redoxreaktionen
am Beispiel der Gewinnung von Roheisen:
Von A wie Autokarosserie bis Z wie Zahnspange. Gegenstände aus Eisen begegnen uns ständig im Alltag. Die Anzahl der Verwendungsmöglichkeiten zeigt die große Vielseitigkeit und Bedeutung von Eisen und seinen Legierungen.
Eisen — ein wichtiger Rohstoff Eisen kommt, abgesehen von eisenhaltigen Meteoriten, in der Natur nur in Verbindungen vor. Es gibt etwa 100 verschiedene Eisenmineralien, von denen nur fünf zur industriellen Eisengewinnung verwendet werden. Hierzu zählen Hämatit (Fe2O3) mit einem Massenanteil von 70 % Eisen und Magnetit (Fe304) mit einem Massenanteil von rund 72 % Eisen. Nach dem bergmännischen Abbau werden die Eisenerze zunächst zerkleinert und vom eisenfreien Begleitgestein getrennt. Im Fall von Magnetit kann diese Trennung sehr leicht über eine Magnetabscheidung geschehen, denn wie sein Name schon andeutet, ist dieses Eisenmineral magnetisch.
Herstellung von Roheisen im Hochofen
Um aus dem Eisenerz Eisen zu gewinnen, müssen die im Erz enthaltenen Eisenoxide reduziert werden. Die Reaktionen finden in einem Hochofen statt. Dieser ist ein bis zu 50 m hoher, auf dem Gegenstromprinzip basierender Gebläseofen. Der aus feuerfesten Steinen gemauerte Innenraum wird von einem Stahlmantel umschlossen. Die heißeren Bereiche des Hochofens werden mit Wasser gekühlt, sodass er einem Dauerbetrieb von zehn Jahren und länger standhält. Von oben wird der Hochofen schichtweise mit Koks und einer Mischung aus Eisenerzen und Zuschlägen befüllt. Letztere dienen dazu, schwer schmelzbare eisenfreie Bestandteile des Erzes, die Gangart, in leicht schmelzbare Verbindungen, die Schlacke, zu überführen. Prinzipiell werden die Eisenoxide durch Kohlenstoff reduziert. Da das Erz und der Kohlenstoff fest sind, ist die Kontaktfläche zwischen ihnen gering, und eine Reaktion kann nur langsam ablaufen.
Ein gasförmiges Reduktionsmittel kann sich hingegen gut mit dem Erz durchmischen. Daher wird bei der Herstellung von Roheisen zunächst der Kohlenstoff zu Kohlenstoffmonooxid oxidiert. Dazu wird am unteren Ende des Hochofens der Wind, 900°C bis 1 300 °C heiße Luft, in den Ofen geblasen. Der Koks reagiert mit dem Sauerstoff im Wind in einer stark exothermen Reaktion zu Kohlenstoffdioxid. Dieses reagiert mit weiterem Koks zu Kohlenstoffmonooxid, das nach oben steigt und die Eisenoxide reduziert. Oben aus dem Ofen tritt das Gichtgas aus. Es enthält neben Stickstoff noch Kohlenstoffdioxid, Kohlenstoffmonooxid und Wasserstoff. Es wird zum Vorheizen des Windes und zur Stromerzeugung genutzt.
Das flüssige Roheisen sammelt sich am Boden des Hochofens. Die auf ihm schwimmende Schlacke schützt das Eisen vor einer Oxidation durch die eingeblasene Luft. Eisen und Schlacke werden in bestimmten Zeitabständen abgestochen. Dazu werden die Abstichlöcher am unteren Ende des Hochofens aufgebohrt und die flüssigen, etwa 1 500 °C heißen Produkte aufgefangen. Im Roheisen sind Verunreinigungen von Kohlenstoff, Phosphor und Schwefel enthalten. Daher ist es hart und spröde. Es wird als Gusseisen verwendet.
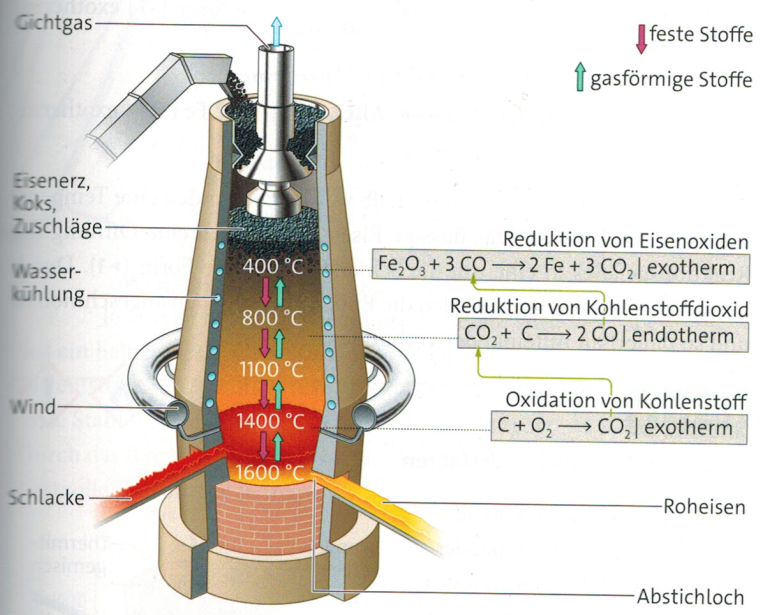
- Kennzeichne in der Reaktionsgleichung für die Reaktion von Eisenoxid (Fe2O3) mit Kohlenstoffmonooxid Oxidation und Reduktion und benenne Oxidations- und Reduktionsmittel
- Erkläre, warum die Schlacke das Roheisen vor einer Oxidation schützt.
- Informiere dich über Eigenschaften und Verwendung von Gusseisen. (Siehe Abbildung)
- Beschreibe die Vorgänge im Hochofen. (Siehe Abbildung)
Mache auch gern eigene Recherchen zu diesem Thema. Lade deine Ergebnisse bei Sdui bis zum 09.02.21 hoch. Für Fragen stehe ich am kommenden Donnerstag von 16 – 17 Uhr oder in schriftlicher Form im Sdui-Chemie-Chat zur Verfügung.
Quelle: Fokus Chemie SI (2018), Cornelsen Verlag, S. 140-141
Kapitel 5 – Weitere Verfahren zur Metallgewinnung
Aluminothermisches Verfahren
Beim aluminothermischen Verfahren werden Metalle durch die Reduktion ihrer Oxide mit dem unedlen Aluminium gewonnen. Durch die hohe Affinität des Aluminiums zu Sauerstoff handelt es sich bei diesem Verfahren um einen stark exothermen Vorgang. Es wird beispielsweise für die Herstellung von Silicium, Mangan und Chrom verwendet. Als Produkt entsteht ein Gemisch aus dem gewünschten Metall und Aluminiumoxid.
Für die Gewinnung hochreiner Metalle ist es nicht geeignet, so darf der Grad der Verunreinigungen beim Silicium zur Halbleiterproduktion maximal ein milliardstel Prozent betragen. Daher ist eine anschließende Reinigung der Metalle notwendig.
Herstellung von Roheisen vor Ort
Beim Verlegen von Eisenbahnschienen müssen die einzelnen Enden der Schienenstränge miteinander verschweißt werden. Hierfür wird flüssiges Eisen benötigt, das die Lücke zwischen den Schienenenden ausfüllen kann. Das flüssige Eisen wird vor Ort mithilfe des aluminothermischen Verfahrens (Thermitverfahren) hergestellt. Dazu wird eine Mischung aus Eisenoxid und Aluminiumgrieß in einem feuerfesten Gefäß gezündet.
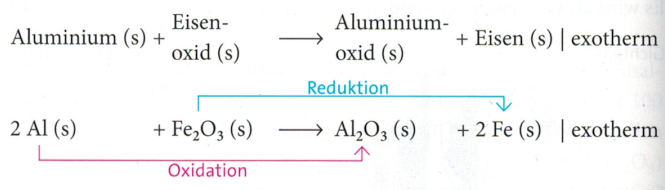
Bei dieser Reaktion entsteht innerhalb weniger Sekunden eine Temperatur von etwa 2 400 °C. Das flüssige Eisen fließt durch eine Öffnung des Reaktionsgefäßes in eine um die Schienen befestigte Form. Durch die hohen Temperaturen werden die Enden der Schienen angeschmolzen und so dauerhaft miteinander verbunden. Eine genauere Erklärung zum Thermitverfahren findet ihr hier:
https://www.youtube.com/watch?v=8iA951MtR3I
Kapitel 6 – Stahl
Stahl — ein wichtiger Werkstoff
Im Gegensatz zum Roheisen lässt sich Stahl im warmen und im kalten Zustand durch Walzen, Pressen, Ziehen und Schmieden formen. Zur Stahlgewinnung müssen zunächst Kohlenstoff und weitere Begleitelemente wie Schwefel und Phosphor z.B. durch Reaktion mit Sauerstoff weitgehend aus dem Roheisen entfernt werden. Der so gewonnene Stahl hat einen Massenanteil an Kohlenstoff von maximal 1,7%. Durch die Zugabe verschiedener Legierungselemente, wie Chrom, Wolfram und Nickel, können Stähle mit unterschiedlichen Eigenschaften hergestellt werden.
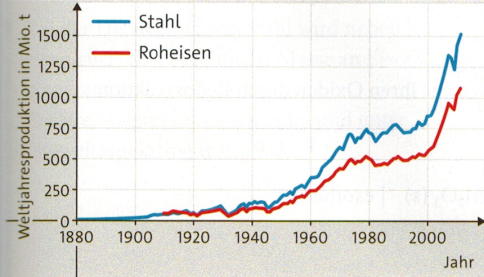
Weltstahlproduktion
Um ein Kilogramm Roheisen im Hochofen zu produzieren, wird fast ein halbes Kilogramm Kohlenstoff benötigt. Daraus entstehen rund 1,8 kg Kohlenstoffdioxid. Stahl wird aber nicht nur aus Roheisen erzeugt. Durch das Recycling von Schrott werden Energie und wertvolle Ressourcen gespart.
Der rasante Anstieg in den letzten zehn Jahren spiegelt auch die Industrialisierung von Schwellenländern wie China und Indien wider.
Quelle: Fokus Chemie SI (2018), Cornelsen Verlag, S. 142-143
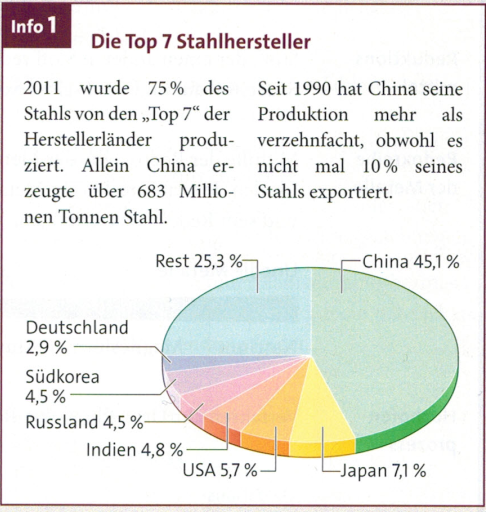
- Informiere dich über die Entwicklung der Weltstahlproduktion (Schaubild oben), z. B. im Internet. Berücksichtige dabei auch Energie- und Umweltaspekte. Stelle die Ergebnisse anschaulich dar.
- Berechne die Gesamtmasse an Kohlenstoffdioxid, die durch die Roheisenproduktion 2011 entstanden ist. Vergleiche mit der Gesamtemission von Kohlenstoffdioxid für 2011.
- Erkunde, welche Auswirkungen der Zusatz von Chrom (Cr), Vanadium (V) und Mangan (Mn) auf die Eigenschaften von Stahl hat.
- Erstelle ein Grafiz zur Herstellung von Stahl aus Roheisen. Nutze dazu die folgenden Informationen.
Vom Roheisen zum Stahl
Roheisen besteht nur zu etwa 90 % aus Eisen. Ein Anteil von bis zu 5 % Kohlenstoff und weitere Begleitstoffe wie Mangan, Silicium, Phosphor und Schwefel machen das Roheisen hart und brüchig. Versucht man es mit dem Hammer zu bearbeiten, so zerspringt es. Roheisen lässt sich weder schmieden noch schweißen, darum eignet es sich nur begrenzt als Werkstoff. Man stellt daraus beispielsweise Abwasserrohre und Heizungsradiatoren her. Etwa 90 % des erzeugten Roheisens werden jedoch zu Stahl verarbeitet.
Stahl. Unter Stahl versteht man eine Eisen-Legierung, die weniger als 2,1 % Kohlenstoff und nur noch sehr geringe Anteile an Mangan, Silicium, Phosphor und Schwefel enthält. Bei der Stahlerzeugung werden die im Roheisen enthaltenen unerwünschten Stoffe durch Sauerstoff oxidiert. Man bezeichnet diesen Vorgang als Frischen. Dieser Prozess wird in einem schwenkbaren, feuerfesten, birnenförmigen Tiegel, dem Konverter, durchgeführt (lat. convertere: umwandeln).
Bei dem heute üblichen Sauerstoffaufblas-Verfahren wird reiner Sauerstoff unter hohem Druck durch ein wassergekühltes Rohr auf eine Schmelze aus Roheisen und bis zu 30% Eisen-Schrott geblasen. Sobald der Sauerstoff auf das Roheisen trifft, kocht und brodelt die sich erhitzende Schmelze. Unter ohrenbetäubendem Lärm sprüht ein Funkenregen aus der Tiegelöffnung. Es handelt sich hauptsächlich um Schlacke, in der ein Teil der Verbrennungsprodukte durch Kalksteinzusätze gebunden ist. Der Rest der Verbrennungsprodukte entweicht als gasförmiges Oxid. Nach etwa 20 Minuten ist der Frischvorgang beendet. Der Konverter wird geschwenkt und der fertige Stahl fließt in eine Gießpfanne. Von dort wird er zur Weiterverarbeitung in ein Walzwerk transportiert.
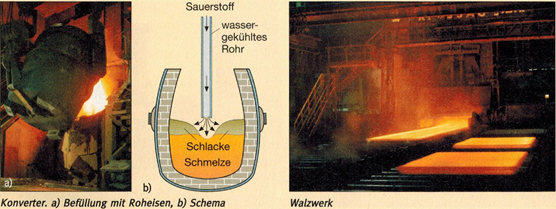
Stahlsorten. In der Technik unterscheidet man mehr als tausend verschiedene Stahlsorten, die sich in zwei große Gruppen einteilen lassen, die unlegierten Stähle (Werkzeugstahl) und die Edelstähle. In beiden Fällen handelt es sich um Eisen mit einem sehr geringen Kohlenstoffgehalt. Edelstähle enthalten zusätzlich Anteile anderer Metalle.
Werkzeugstahl. Nicht legierte Stahlsorten unterschiedlichen Kohlenstoffgehalts machen etwa 75 % des weltweit erzeugten Stahls aus. Stahl mit weniger als 0,25 % Kohlenstoff ist leicht verformbar. Er lässt sich zu Drähten ausziehen oder zu dünnen Blechen walzen. Aus diesem Stahl fertigt man beispielsweise Spezialdrähte, Nägel, Konservendosen und Autokarosserien. Stahl mit einem Kohlenstoffgehalt zwischen 0,25 % und 0,7 % ist weniger verformbar, dafür aber fester. Daraus stellt man Maschinenachsen, Eisenbahnschienen, Feilen, Zangen und Schraubendreher her. Noch härter ist Stahl mit einem Kohlenstoffgehalt von 0,7 % bis 1,5 %. Er wird für die Herstellung von Stahlfedern, Rasierklingen, Handsägen und Messern verwendet.
Edelstahl. Um die physikalischen und chemischen Eigenschaften von Stahl gezielt zu verbessern, werden der Stahlschmelze Legierungsmetalle wie Chrom, Nickel, Cobalt, Wolfram, Molybdän, Mangan, Vanadium oder Titan zugesetzt. Man spricht auch von Stahlveredlern.
Vanadium erhöht die Elastizität und Mangan vermindert die Abnutzung von Stahlwerkzeugen. Stähle mit Molybdän und Wolfram sind sehr hitzebeständig. Chrom verbessert die Korrosionsbeständigkeit und die Härte. Zusammen mit Nickel verhindert es das Rosten (Nirosta). Dieser Stahl wird vor allem zur Herstellung von Spültischen und Küchengeräten verwendet.
Wissenstest
- Erläutere anhand eines selbst gewählten Beispiels, wann eine Redoxreaktion vorliegt.
- Formuliere für die folgenden Reaktionen die Reaktionsgleichungen. Kennzeichne Reduktion, Oxidation sowie Oxidations- und Reduktions-mittel.
- a) Silberoxid reagiert mit Magnesium.
- b) Zinkoxid reagiert mit Aluminium.
- c) Natrium reagiert mit rotem Kupferoxid.
- d) Magnesium reagiert mit Kohlenstoffdioxid.
- Ein Chemielaborant soll aus Aluminiumoxid Aluminium herstellen. Als Reaktionspartner stehen Eisen, Kupfer, Zink und Magnesium zur Auswahl.
- Empfiehl dem Laboranten einen geeigneten Reaktionspartner. Begründe deine Wahl.
- Stelle die Reaktionsgleichung auf und kennzeichne die Teilreaktionen.
